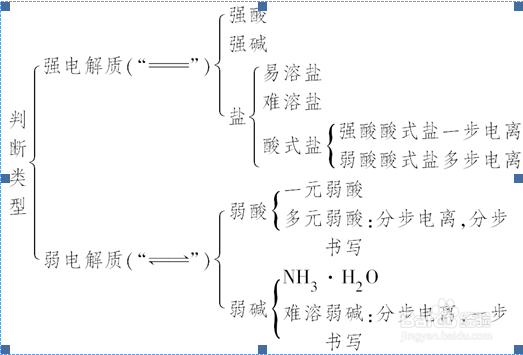
1、一、电解质和非电解质的比较
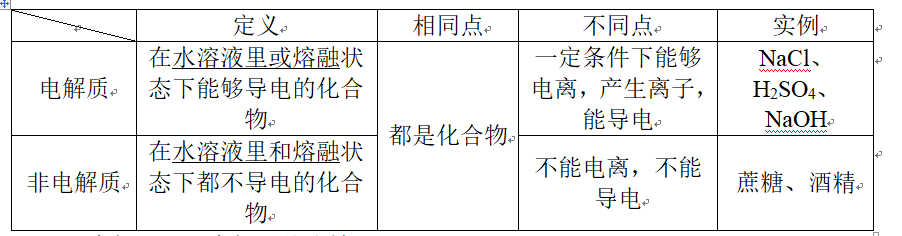
2、二、强电解质和弱电解质的比较
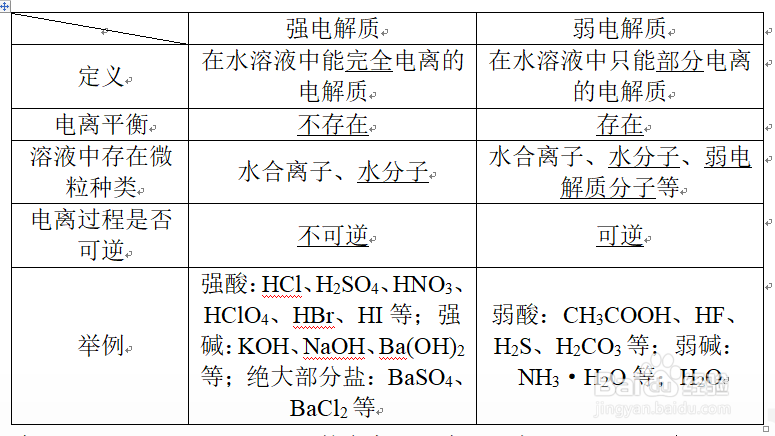
3、三、电离1.概念:电解质在水溶液中或熔融状态下离解成自由移动的离子的过程。2.电离条件:酸的电离条件是溶于水,盐和碱的电离条件是溶于水或熔融。
4、四、电离方程式的书写1.强电解质:完全电离,用“===”表示。如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为H2SO4===2H++SO、NaOH===Na++OH-、(NH4)2SO4===2NH+SO。2.弱电解质:部分电离,用“可逆号”表示。

5、五:高中阶段特殊的电离(3)两性氢氧化物双向电离。如Al(OH)3的电离方程式
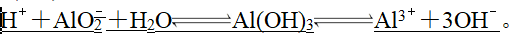
6、3.酸式盐(1)强酸酸式盐完全电离,一步写出。如NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H++SO,在熔融状态下的电离方程式为
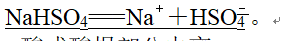
7、(2)多元弱酸酸式盐,第一步完全电离,酸式酸根部分电离。
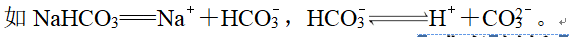
8、典例下列说法正确的是( )A.NaHSO4在熔融状态下的电离方程式为NaHSO4===Na++H++SOB.H2CO3是弱酸,故Na2CO3是弱电解质C.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质D.NaHCO3在水溶液中的电离:NaHCO3===Na++HCO、HCOH++CO

9、电离方程式书写的思维模型